|
2021年,国家药品监督管理局共批准创新医疗器械35个,比2020年增加35%。
2021年,国家药品监督管理局批准境内第三类医疗器械注册4596项,比2020年增加27.6%。批准进口医疗器械注册6718项,比2020年增加7.6%。
这都是技术审评制度改革的重要成果。2015年,国务院发布了一份《关于改革药品医疗器械审评审批制度的意见》,从而拉开了医疗器械审评审批制度的改革。2020年,在由中国欧盟商会主办的“后疫情时代的新常态——创新助力‘健康中国’第二届医疗器械论坛”上,审评中心的领导和专家就近两年审评改革的内容作了梳理与讲解。
-
“医疗器械技术审评审批制度改革”涉及立卷审查、项目分段评审、项目管理人、集体决策、专家咨询管理、对外咨询、补正资料预审查等在内的15项改革措施。这些措施覆盖了从受理、技术审评、数据到审评结论等所有环节。
-
技术审评过程中,咨询与沟通的渠道已经增至10个。此外,随着国家药品监督管理局医疗器械技术审评检查长三角分中心与大湾区分中心相继挂牌成立,审评队伍人员数量增加,可以对外咨询的服务也将更加完善。
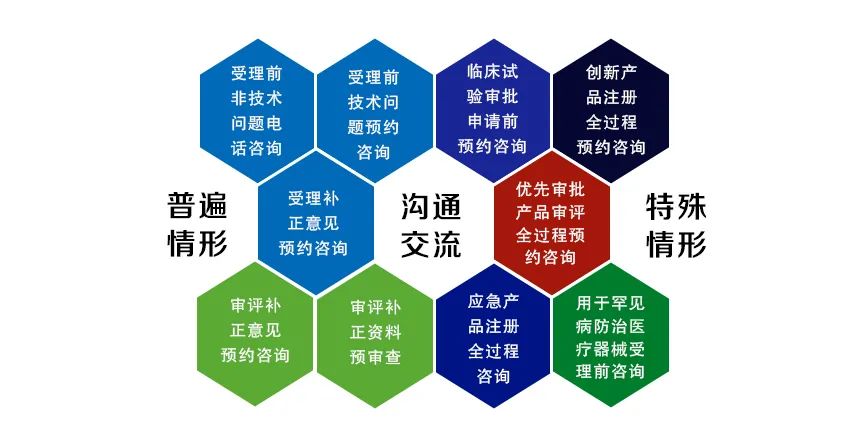
图片来源:审评专家演示PPT
-
应急审批为疫情防控提供了有利保障。2020年1月,国家技术审评中心的专家启动应急审批,仅用4天时间,批准了首批4个体外诊断试剂产品上市。
-
注册审批效率提速。超时率年初为4%、10%,从第二季度开始呈现下降趋势,到第三季度,产品首次注册审评超时率已下降至0.2%,许可变更、延续注册已实现超时率为0。
作为医疗器械审评审批制度改革的见证者,迈迪思创也在时刻关注和研究法规制度的变化,为全球合作客户提供更专业、更高效的医疗器械产品中国上市前一站式法规咨询服务。目前,迈迪思创已拥有超过100名技术人员的专业团队,主要成员为一流跨国企业、国内生产企业、法规咨询机构的注册、临床、质量管理体系与生产管理一线精英。在10年的创新发展历程中,迈迪思创协助全球数百家医疗器械制造商,取得进口与国产医疗器械注册证书1500多张。临床试验研究服务优势领域扩展至多个医疗器械前沿科学,包括手术导航定位系统、AI人工智能辅助诊断、医疗影像设备、创新生物医用材料、骨科植入器械、医疗美容设备与植入剂、体外诊断试剂等。
中国医护网网(yihuwang.com.cn)信息发布或广告宣传请联系邮箱1447260813@qq.com
|
